Najczęściej mamy do czynienia z akumulatorami litowo-jonowymi, oznaczanymi Li-ion (rzadziej Li-jon), z akumulatorami litowo-polimerowymi, oznaczanymi Li-poly lub Li-po, a ostatnio także z litowo-żelazowo-fosfatowymi, oznaczanymi zwykle LiFePO4 lub ściślej LiFePO4. Wszystkie mają napięcie nominalne ponad 3 V.
Ogólnie biorąc, akumulatory litowe oferują największą gęstość energii spośród wszystkich akumulatorów dostępnych na rynku. Nie występuje w nich efekt pamięciowy, samorozładowanie jest niewielkie, trwałość jest duża, w wielu przekracza 1000 cykli pracy. Niemniej wymagają dość troskliwej opieki: zabójcze jest zarówno ich przeładowanie, jak też nadmierne rozładowanie. W praktyce można sobie z tym łatwo poradzić, stosując zabezpieczenia elektroniczne
Ich udział w rynku bardzo szybko rośnie. Pojawiają się wersje o zwiększonej pojemności i lepszych parametrach. Do nich należy najbliższa przyszłość, ponieważ choć pojawiają się zapowiedzi nowych, dużo lepszych rozwiązań, jednak jak na razie nie widać żadnej innej technologii, która mogłaby zagrozić akumulatorom litowym.
Zasada działania
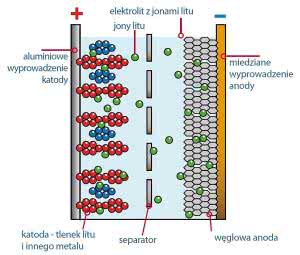
W akumulatorze litowym podstawą magazynowania energii jest ruch dodatnich jonów litu między anodą i katodą w przewodzącym elektrolicie, co związane jest z przemianami chemicznymi.
Eksperymenty z bateriami litowymi podjęto już w roku 1912 (G. N. Lewis), jednak dopiero na początku lat siedemdziesiątych pojawiły się na rynku pierwsze jednorazowe baterie litowe. Ich napięcie było zależnie od użytych związków chemicznych. Większość miała napięcie nominalne około 3 V, jednak dostępne są także ogniwa litowe o napięciu 1,5 V.
Eksperymentalne akumulatory litowe realizowano już od początku lat 70, jednak w ogniwach, które maja być ładowane kluczowym praktycznym problemem jest duża aktywność chemiczna metalicznego litu, który w razie przeładowania czy rozszczelnienia może spowodować pożar.
Ponadto w prototypowych akumulatorach, gdzie metaliczny lit był jedną z elektrod, tworzyły się tzw. dendryty - cienkie włókna metalowe, które potrafiły zewrzeć baterię, a nawet doprowadzić do jej pożaru. Dopiero zastosowanie zamiast metalicznego litu jego związków, które mogły oddawać lub przyjmować jony litu, otworzyło drogę do realizacji bezpiecznych dla użytkownika akumulatorów. Pierwsze akumulatory litowo-jonowe pojawiły się w roku 1991 jako źródło zasilania kamery Sony CCD TR1.
Dziś dostępnych jest kilka odmian, które choć noszą różne nazwy, wszystkie są akumulatorami litowo-jonowymi. Dodatnia elektroda wykonana jest w nich nie z metalicznego litu, tylko z różnych związków litu, które mogą oddawać i przyjmować jony litu. Można powiedzieć w największym uproszczeniu, że elektroda dodatnia (katoda) zbudowana jest ze związków litu, natomiast ujemna (anoda) zbudowana jest najczęściej z jakiejś odmiany węgla (choć niektóre odmiany mają anody z innych materiałów). Elektrody muszą być od siebie odseparowane, żeby nie nastąpiło zwarcie, natomiast między nimi musi być umieszczony elektrolit, który pozwoli na przemieszanie się dodatnich jonów litu między elektrodami.
Ponieważ kluczowym czynnikiem w tych akumulatorach jest wymiana jonów litu między elektrodami, badano najróżniejsze związki litu by wykorzystać takie, które łatwo oddają i przyjmują te jony. Po latach badań okazało się, że do budowy katody nadają się związki litu, mające specyficzną budowę kryształów. Z grubsza biorąc chodzi nie tyle o szczegóły składu chemicznego, co o budowę siatki krystalicznej. Rysunek 1 pokazuje zasadę budowy akumulatorów litowo-jonowych.
Związki o bardzo podobnym składzie chemicznym zdecydowanie różniły się możliwościami i chęcią do oddawania i przyjmowania jonów litu. Naukowcy zbadali dziesiątki i setki różnych związków litu (a także licznych innych pierwiastków) i doszli do wniosku, że najlepiej nadają się substancje o specyficznej budowie siatki krystaliczna (w tym typu spinelu oraz oliwinu).
Te związki to tlenki metali, ale o tyle specyficzne, że nie tlenki jednego metalu (litu), tylko dwóch, a nawet trzech. Dla elektronika jest to czarna magia. Odpowiednią przestrzenną strukturę krystaliczną tworzą wiązania atomów tlenu z mieszanką atomów metali: na pewno litu, a do tego innego metalu lub metali.
Co ważne, ubytek jonów litu podczas ładowania nie niszczy struktury krystalicznej katody, tylko zmienia jej skład chemiczny. Po pierwsze zazwyczaj nie wszystkie atomy litu są uwalniane z katody (co akurat nie jest zaletą), po drugie atomy pozostałych pierwiastków nadal zachowują wcześniejszą strukturę krystaliczną materiału.
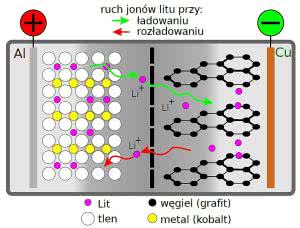
W pierwszych praktycznie użytecznych akumulatorach litowych (Sony 1991) katoda zbudowana była z tlenku litu i kobaltu - LiCoO2. Do dziś akumulatory oparte na tym związku są bardzo popularne. Węglowa elektroda ujemna na początku budowana była z... koksu, który ma porowatą strukturę, a obecnie wykonywana jest z grafitu.
Dla akumulatorów na bazie LiCoO2 odwracalne procesy chemiczne można zapisać następująco:
LiCoO2 ↔ Li1-xCoO2 +xLi+ +xe- +xLi+ +xe- +xC6 ↔ xLiC6

Fotografia 6. Akumulatory do aparatów, kamer i laptopów najczęściej zawierają dwa lub więcej akumulatorów cylindrycznych
Podczas ładowania dodatnie jony litu przechodzą z katody do węglowej anody, gdzie łączą się z atomami węgla w specyficzną warstwową strukturę opisywaną wzorem chemicznym LiC6. Podczas rozładowania jony litu wracają z anody do katody. Ilustruje to rysunek 2.
Zasada działania wydaje się prosta. Jednak z uwagi na liczne problemy, dopiero po około dwudziestu latach badań udało się wytworzyć użyteczne akumulatory litowe. O ile akumulatory kwasowo-ołowiowe oraz niklowe, mają stosunkowo proste zasady działania, o tyle w akumulatorach litowych kluczowe znaczenie ma kilka problemów fizykochemicznych oraz technologicznych, które trudno było zbadać i rozwiązać.
Akumulatory z kobaltem mają dobrą zdolność magazynowania energii i inne cenne właściwości, jednak w praktyce dość istotnym problemem praktycznym są wysokie ceny kobaltu i pewne trudności technologiczne. Z uwagi na koszt wytwarzania, z początku budowano jedynie akumulatory litowo-jonowe (LiCoO2) o małych rozmiarach, przeznaczone do kosztownego sprzętu elektronicznego.
Jednocześnie trwały eksperymenty z substancjami, głównie tlenkami o podobnej budowie krystalicznej, ale zawierającymi inny metal zamiast kobaltu. Dość szybko okazało się, iż porównywalne właściwości ma zdecydowanie łatwiej dostępny mangan, ale nie związek LiMnO2, tylko LiMn2O4.
Akumulatory litowo-jonowe nazywane są ogólnie LIB (Lithium-Ion Battery), a wersje z LiCoO2 oznaczane bywają LCO (ale nie LIC, co oznacza litowe kondensatory). Opracowane trochę później akumulatory litowo-jonowe z katodą z LiMn2O4, oznaczane LMO, nazywane manganowymi lub spinelowymi. Zasadniczą ich wadą jest gęstość energii, o połowę mniejsza od kobaltowych, a istotną zaletą - możliwość oddawania dużych prądów.
Okazało się, że korzystniejsze niektóre cechy mają kryształy tlenku zawierające atomy litu oraz manganu i kobaltu LiMnCoO2 (oznaczenie LMC), a jeszcze bardziej niklu, manganu i kobaltu LiNiMnCoO2 (oznaczenie NMC). Wykorzystanie takich materiałów pozwalało optymalizować parametry akumulatorów do rozmaitych zastosowań.
Prowadzono też badania nad różnymi innymi związkami litu, w tym zawierającymi tanie i popularne żelazo. Niestety, bodaj najprostszy pokrewny związek LiFeO2 słabo oddaje i przyjmuje jony litu. Wnikliwe badana wykazały, iż dużo lepsze parametry oferują związki o budowie krystalicznej typu oliwinu, a konkretnie LiFePO4, czyli związek zawierający też fosfor.
Zasada działania akumulatora "żelazowego" jest taka sama jak we wcześniejszych rozwiązaniach: kluczowe znaczenie ma krystaliczna budowa LiFePO4, który podczas ładowania oddaje jony litu i pozostaje jako fosforan żelaza FePO4 o takiej samej budowie krystalicznej.
Po przezwyciężeniu szeregu problemów, akumulatory żelazowo-fosforanowe, zwane też fosfatowymi (LFP), pojawiły się na rynku. Są to też jak najbardziej akumulatory litowo-jonowe. Mają napięcie nominalne 3,2 V, natomiast wcześniej omawiane Li-Ion i Li-Po (LCO, LMO, LMC, NMC) maja napięcie 3,6...3,7 V.
We wszystkich katoda jest zbudowana z materiału łatwo oddającego (ładowanie) i przyjmującego (rozładowanie) jony litu, a anoda zawiera węgiel. Trwają też intensywne badania nad innymi związkami litu, czego wynikiem jest pojawianie się na rynku nowych odmian akumulatorów.
Coraz częstsze są informacje o akumulatorach litowo-jonowych zawierających glin (NCA - LiNiCoAlO2), tytan (LTO - Li4Ti5O12), gdzie zaletą jest możliwość bardzo szybkiego ładowania, czy siarkę (LIS - Li2S8), gdzie zaletą jest teoretyczna gęstość magazynowanej energii do 500 Wh/kg. Jednak póki co, największą gęstość energii, do 200 Wh/kg, oferują wersje kobaltowe (LiCoO2).
I jeszcze jeden ważny szczegół. W akumulatorach litowych typu LCO, LMO, LMC stosowano i nadal stosuje się ciekłe elektrolity o różnym składzie, w tym wodne roztwory różnych bardziej i mniej bezpiecznych substancji zawierających lit, jak choćby LiPF6, czyli sześciofluorofosforan litu, czy LiBOB, którego polska nazwa to bis(szczawiano)boran litu.
Istotnym wynalazkiem było zastąpienie cieczy stałym elektrolitem w postaci przewodzących polimerów, zawierających sole litu. Tak powstały akumulatory litowo-polimerowe, oznaczane Li-Po, LiPo lub LIP czyli akumulatory litowo-jonowe, zawierające kobalt lub mangan, gdzie ciekły elektrolit zastąpiono stałym. Zasadniczo polimerowy elektrolit zwiększył rezystancję wewnętrzną, ale zwiększył bezpieczeństwo przez eliminację możliwości pożaru.
Pierwsze akumulatory litowo-polimerowe były ogniwami cylindrycznymi (o kształcie walca - "paluszka") - przykład na fotografii 3, natomiast zastąpienie ciekłego elektrolitu stałym otworzyło drogę do realizacji akumulatorów o niemal dowolnym kształcie. Zaczęły się upowszechniać akumulatory litowe o kształcie prostokątnych poduszek - fotografia 4.
Tu warto wyjaśnić pewne niejasności. Otóż zasadniczo Li-Po lub LiPo oznacza akumulatory ze stałym, polimerowym elektrolitem. Jednak niedostateczna świadomość użytkowników i względy marketingowe spowodowały, że polimerowymi nazywa się też akumulatory z ciekłym elektrolitem, tylko mające kształt prostokątnych poduszek z tworzywa.
Dla niektórych wystarczającym powodem, by mówić o akumulatorach polimerowych była też obecność w środku separatora (porowatej folii) z tworzywa sztucznego. Ponieważ wcześniejsze wersje miały metalową obudowę, dla innych takim powodem była obecność miękkiej, plastikowej obudowy.
Pomimo tego rodzaju niejasności podstawowe zasady są proste: akumulatory polimerowe to też akumulatory litowo-jonowe, zwykle zawierające kobalt lub mangan, choć istnieją też "poduszkowe" LiFePo4) i ich podstawowe parametry są takie, jak klasycznych z ciekłym elektrolitem.
Obecnie na rynku dominują akumulatory litowo-jonowe LCO, LMO, LMC, NMC, czyli zawierające kobalt, mangan i nikiel w wykonaniach klasycznych z ciekłym elektrolitem i ze stałym elektrolitem polimerowym. Coraz większą popularność zyskują akumulatory LFP, czyli żelazowo-fosforanowe. W ofercie rynkowej można też znaleźć ulepszone akumulatory fosforanowe, domieszkowane itrem, oznaczone LiFeYPO4.
Rodzaje akumulatorów litowych
Pierwsze akumulatory litowo-jonowe były wykorzystywane w kamerach i aparatach Sony. Były to zasadniczo cylindryczne "paluszki". Od klasycznych "paluszków" wielkości AA (R6) i AAA (R03) różnią się przede wszystkim napięciem - ponad 3 V.
Cylindryczne ogniwa litowe najczęściej oznaczane są kodem liczbowym, gdzie pierwsze dwie cyfry to średnica, a dwie następne to długość w milimetrach. Zdecydowanie najpopularniejsze są ogniwa 18650, czyli o średnicy 18 mm i długości 65 mm - porównanie z "paluszkiem AA" (R6) pokazano na fotografii 5.
Cylindryczne akumulatory litowe dostępne są też w innych mniej i bardziej popularnych wielkościach: 18500, 17670 (2xCR123), 17500, 14670, 14500 (AA), 16340 (CR123), 15266 (CR2), 10440 (AAA), 14250 (1/2 AA). 10220 (1/2 AAA), 10280, 10180 (2/5 AAA).
Akumulatory do aparatów, kamer i laptopów najczęściej zawierają dwa lub więcej akumulatorów cylindrycznych - przykład na fotografii 6.
Dostępnych jest też mnóstwo odmian litowych akumulatorów o kształcie płaskiej poduszki - najczęściej jest to jedno ogniwo o napięciu 3,7 V i pojemności od kilkudziesięciu mAh (fotografia 7) do kilku amperogodzin (fotografia 8). Według potocznych wyobrażeń, wszystkie powinny być akumulatorami polimerowymi, ale wcale nie jest to regułą.
Mały akumulator polimerowy pokazany jest na fotografii 9. Niemniej płaski kształt mają też klasyczne akumulatory Li-Ion z ciekłym elektrolitem do smartfonów - przykład na fotografii 10. Fotografia 11 pokazuje pojedynczy akumulator Li-Ion (nie Li-Poly) 3,7 V o ciężarze 800 g, wymiarach 288 mm×218 mm×75 mm i pojemności 36 Ah.
Z kolei rysunek 12 pokazuje akumulator LFP, czyli LiFePO4, który w ofercie handlowej (www.batteryspace.com) jednoznacznie nazwany jest polimerowym. Nie sposób stwierdzić, czy zawiera on polimerowy elektrolit, czy tylko "polimerową obudowę".
Dostępne są też rozmaite zestawy o wyższym napięciu. Fotografia 13 pokazuje zestaw modelarski o napięciu 22,2 V, zawierający 6 ogniw, zwanych celami. Warto nadmienić, że nie tylko litowe akumulatory modelarskie w oznaczeniu zawierają informację o liczbie i sposobie połączenia ogniw w pakiecie.
Litera S (serial) wskazuje ile ogniw jest połączonych w szereg, co decyduje o napięciu, a litera P (parallel) wskazuje, ile ogniw jest połączonych równolegle, co zwiększa pojemność. Przykłady: 1S2P - 2 ogniwa połączone równolegle (3,7 V), 2S2P - w sumie 4 ogniwa, napięcie 7,4 V, 3S3P - 9 ogniw, napięcie 11,1 V 6S1P - sześć ogniw, napięcie 22,1 V.
Na obudowach akumulatorów modelarskich zazwyczaj też podawana jest ich maksymalna wydajność prądowa, ale nie w amperach, tylko jako krotność pojemności nominalnej C. Przykładowo akumulator 3200 mAh 30C może pracować przy obciążeniu prądem 96 A (3,2 A×30). W niektórych modelach (np. w samolotach, helikopterach i najszybszych samochodach) kluczowe znaczenie ma możliwość oddawania bardzo dużych prądów, nawet 20...30C.
Co ciekawe, istnieją akumulatory o prądzie maksymalnym do 100C. Fotografia 14 pokazuje modelarski akumulator ProTek 2S1P 7,4 V, 7,4 Ah, który może pracować z prądem ciągłym 100C, czyli 740 A! Oczywiście przez krótki czas poniżej pół minuty - tylko na tyle pozwoli pojemność.
Dostępne są też akumulatory litowe, które mają zastąpić dużo cięższe akumulatory kwasowe - przykład na fotografii 15. Od niedawna dostępne są też akumulatory litowe o naprawdę dużej pojemności. Fotografia 16 pokazuje pojedyncze ogniwo LiFePO4 o wymiarach 106 cm x 79 cm x 17 cm i ciężarze 173 kg, które ma pojemność 7000 Ah. Winston Battery ma w swej ofercie także podobny akumulator o pojemności 10 tysięcy amperogodzin!
Z kolei fotografia 17 (www.enerdel.com) pokazuje zestaw o wymiarach 2 m×1,1 m×0,27 m, ciężarze 420 kg, napięciu 650 V i prądzie 160 A, magazynujący 20 kWh energii. Składa się z 360 ogniw o pojemności 16 Ah w konfiguracji 180S2P. Może być wykorzystany do napędu samochodu lub autobusu, albo też w przemysłowych systemach UPS.
Właściwości i przeznaczenie
Zasadniczo akumulatory na bazie LiCoO2 oferują największa gęstość energii, do 170 Wh/kg, natomiast manganowe mogą oddawać największe prądy.
Obecnie liczni producenci oferują różne własne wersje i zamiast interesować się ich składem chemicznym, należy raczej zainteresować się parametrami z karty katalogowej. Poszczególne odmiany mają różną trwałość, zwykle 500...1000 cykli pracy.
Różnią się zakresami temperatur pracy oraz maksymalnym prądem rozładowania i ładowania. Dla użytkownika i dla elektronika-konstruktora takie szczegóły mają istotne znaczenie, ale ważne jest też, jaka jest aktualna oferta rynkowa i jakie są ceny.
Oprócz ogniw litowych ogólnego przeznaczenia, choćby najpopularniejszych ogniw 18650, dostępne są też litowe akumulatory produkowane dla konkretnych zastosowań i grup odbiorców.
Oferta akumulatorów litowych jest bardzo bogata, jednak zawsze trzeba pamiętać, iż wszystkie akumulatory litowe są bardzo wrażliwe zarówno na przeładowanie, jak też nadmierne rozładowanie. W obu przypadkach akumulator ulega trwałemu uszkodzeniu, a przeładowanie może też grozić pożarem.
Do dziś w Internecie można znaleźć filmy pokazujące palące się akumulatory litowe. Takie przypadki zdarzały się tuż po wprowadzeniu na rynek, gdy akumulatory nie były jeszcze w pełni dopracowane i gdy nie było jeszcze odpowiednich ładowarek, a użytkownicy nie doceniali wagi problemu.
Obecnie w telefonach, tabletach, aparatach, laptopach pracuje już nie miliony, a miliardy ogniw litowych i doniesienia o ich uszkodzeniach są sporadyczne. Współczesne akumulatory litowe są naprawdę bezpieczne, chyba że użytkownik zafunduje im ekstremalne warunki pracy.
Ładowanie
Zasadniczo warunek bezpiecznego lądowania jest jeden: nie wolno przekroczyć dopuszczalnego napięcia i prądu ładowania. Podstawowa zasada jest prosta: wszelkie akumulatory litowe należy ładować najpierw przy stałym prądzie, wynoszącym zwykle 0,2C...0,3C, tylko w niektórych dopuszczalny jest prąd ładowania 0,5C...1C, a gdy napięcie wzrośnie do wyznaczonej wartości, ładowarka powinna utrzymywać te wartość napięcia, a prąd będzie samoczynnie spadał.
Dla akumulatorów Li-Ion i Li-Po o napięciu nominalnym 3,7 V to napięcie ładowania wynosi 4,20 V±50 mV. Natomiast dla 3,2-woltowych akumulatorów LiFePO4 maksymalne napięcie ładowania wynosi zazwyczaj 3,60...3,65 V, ale szczegółów należy szukać w karcie katalogowej, bo niektóre mają napięcie maksymalne 3,8...3,9 V.
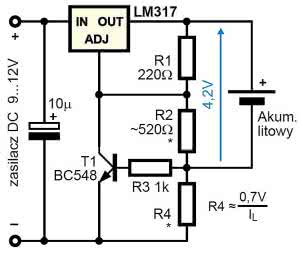
Istnieje wiele dedykowanych układów scalonych "ładowarek litowych", jak choćby rodzina Microchip MCP738XX, w szczególności popularny układ MCP73833. Niemniej ładowanie pojedynczego ogniwa okazuje się bardzo proste: wystarczy do ładowania wykorzystać źródło napięcia 4,2 V (albo 3,6 V dla LiFePO4) z ogranicznikiem prądowym odpowiednim dla danego akumulatora.
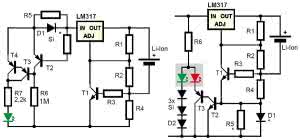
Prosta wersja ładowarka pokazana jest na rysunku 18 (zamiast LM317 można zastosować np. 5-amperowy LM338). Rezystory R1, R2 ustalają napięcie wyjściowe (4,20 V). Tranzystor T1 i rezystor R4 to ogranicznik prądowy. W pierwszej fazie ładowania napięcie akumulatora jest niższe od 4,2 V i wtedy działa ogranicznik prądowy. Tranzystor T1 jest częściowo otwarty i zmniejsza napięcie na akumulatorze, żeby spadek napięcia na R4 był około 0,7 V. Kiedy akumulator osiągnie 4,2 V, prąd ładowania samoczynnie zacznie się zmniejszać praktycznie do zera.
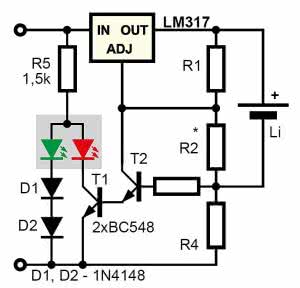
Układ z rys. 18 może być dobrym punktem wyjścia do realizacji ładowarek o ściśle określonych właściwościach, ale ma pewne znaczące wady, w tym brak obwodu kontroli naładowania. Tę słabość można byłoby łatwo poprawić, na przykład dodając dwukolorową, czerwono-zieloną diodę ze wspólną anodą według rysunku 19.
Gdy napięcie akumulatora jest niższe od 4,2 V i gdy jest on ładowany maksymalnym prądem, przewodzą oba tranzystory T1, T2. Tranzystor T2 zaświeca czerwoną strukturę diody LED. Zielona struktura nie świeci, bo ma wyższe napięcie przewodzenia, a tym bardziej, że w szereg z nią włączone są dwie zwykłe diody krzemowe. Gdy prąd ładującego akumulatora się zmniejszy, tranzystory T1, T2 zostaną zatkane i zaświeci zielona struktura diody LED.
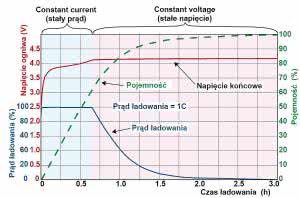
Jednak osiągnięcie napięcia 4,2 V i zaświecenie zielonej diody nie oznacza wcale pełnego naładowania akumulatora. Rysunek 20 pokazuje krzywe ładowania akumulatora litowo-jonowego standardową metodą CCCV, czyli najpierw prądem o stałej wartości (CC - constant current), a potem przy stałej wartości napięcia (CV - constant voltage) prądem o (samoczynnie) malejącej wartości.
Prąd ładowania jest w tym przypadku duży, wynosi 1C, czyli liczbowo równa się pojemności akumulatora. Teoretycznie przy takim prądzie idealny akumulator powinien naładować się w pełni przez jedną godzinę. Przy takim prądzie napięcie akumulatora osiąga wartość 4,2 V już po około 0,66 godziny czyli po około 40 minutach, co pokazuje czerwona linia. Akumulator powoduje, że od tej chwili prąd ładowania sam zaczyna się zmniejszać.
Teoretycznie przy prądzie 1C, w czasie 0,66 godziny akumulator powinien uzyskać 0,66 swojej pojemności nominalnej. Jak jednak pokazuje zielona linia przerywana, do czasu osiągnięcia napięcia 4,2 V akumulator zdąży się naładować do co najwyżej do 60% swojej pojemności nominalnej, w praktyce prawdopodobnie nieco mniej (niektóre źródła podają większe wartości, nawet do 80%, w każdym razie na pewno nie będzie to pełne naładowania, a ze względu na niedoskonałą sprawność będzie to mniej, niż wynosi władowana pojemność).
Jeżeli odłączymy akumulator w chwili, gdy napięcie na nim osiągnie 4,2 V i gdy prąd ładowania zacznie się zmniejszać, to prawdopodobnie jego pojemność wyniesie tylko 50...60% nominalnej. Pojemność nominalną (C) uzyskamy po około trzech godzinach, gdy prąd ładowania spadnie do wartości rzędu 0,01C, czyli 1% pierwotnej wartości.
I tu mamy dylemat. Jeżeli chcemy szybko naładować akumulator litowo-jonowy, nie uzyskamy pełnej pojemności. A jeżeli chcemy uzyskać pełną pojemność, musimy pogodzić się z czasem ładowania dużo dłuższym, niż wynikałoby z zadanej dużej wartości prądu (1C). I nie ma dobrego sposobu, żeby ten problem obejść.
W prostym układzie z rysunku 19 zaświecenie zielonej diody wcale nie oznacza pełnego naładowania, a jedynie naładowanie do 50...60% pojemności. Po zaświeceniu zielonej lampki ładowanie należałoby kontynuować jeszcze przez co najmniej godzinę. Można się więc zastanawiać nad sensem takiej sygnalizacji.
Jeżeli chcielibyśmy mieć informację o pełnym naładowaniu akumulatora, należałoby zastosować oddzielny obwód czujnika prądowego, który sygnalizowałby spadek wartości prądu ładowania do poziomu od kilku do 20% pierwotnej wartości. W omawianym układzie można to zrobić na przykład jak pokazuje rysunek 21. W obu wersjach wstawiona jest szeregowa dioda krzemowa D1 o prądzie większym od maksymalnego prądu ładowania.
Ja wiadomo, na takiej diodzie, zależnie od wartości prądu wystąpi spadek napięcia rzędu 0,55...0,8 V. I to wystarczy do otworzenia współpracującego tranzystora. A już znikome otwarcie tranzystora T2 uniemożliwi świecenie zielonej diody LED. Gdyby nie było rezystora R5, zielona lampka byłaby wygaszona nawet przy maleńkiej wartości prądu ładowania. Rezystor R5 wyznacza, przy jak małym prądzie ładowania przestaje przewodzić tranzystor T2, co powoduje zaświecenie zielonej lampki. Dobierając wartość R5 można więc ustalić, przy jakim stopniu naładowania akumulatora zaświeci się zielona lampka.
Jeśli chcemy ładować szybko, zastosujemy możliwie duży prąd ładowania w fazie CC, dozwolony przez producenta posiadanych akumulatorów, podany w firmowych danych katalogowych. Ale czas ładowania do pełnej pojemności będzie około 3-krotnie dłuższy, niż wynikałoby z podzielenia nominalnej pojemności C przez prąd ładowania.
Taka decyzja to nie jest jedyny dylemat. Koncentrujemy się tutaj jedynie na pojemności oraz na czasie ładowania. A w praktyce kolejnym bardzo istotnym parametrem jest trwałość akumulatora. Wszystkie akumulatory, także najnowocześniejsze litowe różnych typów i odmian, mają ograniczoną trwałość. Trwałość wyraża się liczbą cykli ładowania/rozładowania, a jako koniec życia akumulatora przyjmuje się zwykle spadek jego pojemności do 80% wartości nominalnej.
Trwałość akumulatora litowo-jonowego (i litowo-polimerowego) zależy od szeregu czynników, między innymi od temperatury pracy i przechowywania. Dla zwiększenia trwałości zaleca się przechowywanie nieużywanych akumulatorów Li-Ion (Li-Poly) w lodówce i co dość istotne, najlepiej naładowanych tylko do 40% pojemności.
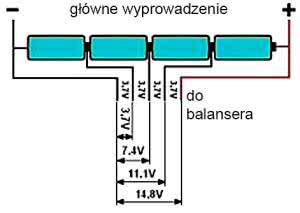
Rysunek 24. Akumulatory modelarskie mają dodatkowe złącze, na które wyprowadzono bieguny wszystkich ogniw składowych
Okazuje się też, że długotrwałe dołączenie do napięcia 4,2 V, znacząco zmniejsza czas życia akumulatorów. Długie pozostawianie naładowanych akumulatorów w ładowarce na pewno nie grozi ich przeładowaniem, bo prąd ładowania samoczynnie spada do wartości bliskiej zeru. Jednak długie pozostawanie pod napięciem 4,2 V jest niekorzystne i powoduje zmniejszenie trwałości.
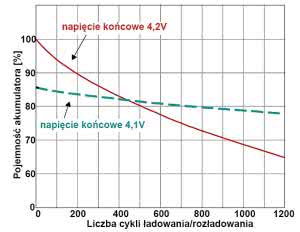
Trwałość jest też silnie związana z innymi czynnikami. Przyjęło się uznawać napięcie 4,2 V jako "standardowe" napięcie końcowe ładowania akumulatorów litowo-jonowych i litowo-polimerowych (ale niższe dla żelazowo-fosforanowych LiFePO4 - zwykle 3,6 V). Tymczasem wartość 4,2 V nie jest "jedyną słuszną wartością", tylko swego rodzaju kompromisem. Interesujące informacje zawiera rysunek 22.
Wskazuje on, że napięcie końcowe może wynosić od 4,0 V do co najmniej 4,3 V. Czym niższe napięcie końcowe, tym oczywiście mniejsza uzyskana pojemność, co pokazuje czarna przerywana linia i skala z prawej strony rysunku. Jednak jak pokazuje krzywa niebieska, obniżanie napięcia końcowego zdecydowanie zwiększa trwałość.
Przy "nominalnym" napięciu 3,2 V trwałość szacowana jest na około 500 cykli pracy, o tyle przy napięciu końcowym 4,1 V jest aż dwukrotnie większa, natomiast pojemność nie zmniejsza się dramatyczne, wynosi około 84% pojemności "nominalnej". Z kolei zwiększenie napięcia końcowego do 4,3 V powoduje poważne, ponaddwukrotne zmniejszenie trwałości do około 200 cykli, natomiast przyrost pojemności wynosi tylko 15%.
Rysunek 22 wyraźnie wskazuje, że jeśli komuś zależy na dużej trwałości (np. w przypadku kosztownych akumulatorów), to powinien poważnie zastanowić się nad obniżeniem końcowego napięcia ładowania. Przy zmniejszeniu napięcia końcowego o 0,1 V strata pojemności będzie niewielka, najwyżej 15%, a wydłużenie żywotności - duże, mniej więcej dwukrotne.
Dodatkowe argumenty za taką zmianą podaje rysunek 23. Jak widać, obniżenie napięcia końcowego powoduje też spowolnienie utraty pojemności. Po 450 cyklach akumulator ładowany tylko do napięcia 4,1 V będzie miał pojemność większą, niż ładowany "standardowo" do 4,2 V.
Co prawda, nie wszyscy producenci podają tego rodzaju szczegółowe informacje, a wyroby niektórych firm mogą mieć nieco inne właściwości od tu opisanych, jednak trzeba pamiętać, że napięcie końcowe 4,2 V to kompromis między pojemnością, trwałością, a po części też czasem ładowania.
Praca cykliczna i buforowa, przechowywanie. Wcześniej omawiane akumulatory ołowiowe i niklowe powinny być przechowywane w stanie naładowanym, natomiast z akumulatorami litowymi sprawa jest bardziej złożona. Liczne źródła podają, iż akumulatory litowe powinny być przechowywane w stanie częściowego naładowania.
Ponieważ niekorzystne dla trwałości jest pozostawanie akumulatorów litowych cały czas pod napięciem ładowania (4,2V dla Li-Ion i Li-Po, 3,6V dla LiFePO4), dlatego przy pracy buforowej konieczne jest obniżenie napiecia ładowania. Szczegółów należy szukać u producentów.
Ładowanie "równoległe i szeregowe". Ogniwa litowe podczas ładowania można łączyć równolegle i ładować jednocześnie - to najprostsza metoda ładowania kilku ogniw naraz, zapewniająca wyrównanie ich parametrów.
Duży problem pojawia się, gdy ogniwa są trwale połączone w szereg. W akumulatorach ołowiowych ogniwa też są połączone w szereg i cały akumulator jest ładowany do napięcia, będącego sumą napięć na ogniwach. Takie "szeregowe" ładowanie w przypadku dużo wrażliwszych akumulatorów litowych doprowadziłoby do katastrofy z uwagi na nieuniknione różnice parametrów ogniw.
Jedno z ogniw naładowałoby się nieco wcześniej i napięcie na nim wzrosłoby nadmiernie, doprowadzając do jego uszkodzenia. W przypadku szeregowego połączenia ogniw, trzeba indywidualnie kontrolować napięcie na każdym ogniwie.
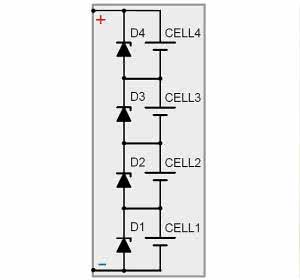
Właśnie dlatego akumulatory modelarskie mają dodatkowe złącze, na które wyprowadzone są bieguny wszystkich ogniw składowych - patrz rysunek 24 i fotografie 13, 14. Niezależną kontrolę każdego ogniwa musi zapewnić ładowarka. Podobnie jest przy ładowaniu akumulatorów litowych do niektórych elektronarzędzi - ładowarka ma kilka styków. Rozwiązania układowe są różne, ale ogólnie mówi się, że są to ładowarki z balanserem (balancerem).
Istnieje też mnóstwo akumulatorów, które mają kilka cel, ale tylko dwa wyprowadzenia. Wtedy wewnątrz obudowy akumulatora na pewno wbudowany jest układ elektroniczny, pełniący rolę balansera podczas ładowania.
Balansery mogą być różne. W najprostszym przypadku mogłyby to być dobrane diody Zenera - rysunek 25. W praktyce wymaganą dokładność mogą zapewnić podobne rozwiązania z układami TL431. W praktyce spotyka się też wbudowane na stałe, znacznie bardziej złożone balansery (rysunek 26), które pełnią ważną rolę nie tylko podczas ładowania...
Wszechstronna ochrona
Akumulatory litowe są też bardzo wrażliwe na nadmierne rozładowanie. Tymczasem w wielu zastosowaniach łatwo o wyładowanie "do zera", a to grozi nieodwracalną utratą pojemności. Ogólnie uznaje się, że szkodliwe jest rozładowanie akumulatora litowego poniżej 2,5 V/celę.
W zasadzie dobry konstruktor przy odrobinie wysiłku może tak zaprojektować układ elektroniczny, żeby wyłączył się samoczynnie, gdy napięcie zasilania spadnie poniżej określonej wartości. Ale nie zawsze można liczyć, że zasilany układ ma taką cenną cechę.
Groźne dla akumulatora litowego jest też jego przeciążenie, czyli próba pobrania prądu większego od dopuszczalnego. Nastąpi wtedy nadmierny wzrost temperatury, co może nawet grozić pożarem.
Szkodliwy, a nawet niebezpieczny może też być nadmierny prąd podczas ładowania. Jednak stosunkowo prosto można zapobiec przeładowaniu - wystarczy odpowiednia ładowarka i ewentualnie balanser.
Trudniej zabezpieczyć akumulator przed "złym obciążeniem", niemniej jest to możliwe.
Wprawdzie istnieje wiele akumulatorów litowych "pojedynczych", które nie mają żadnych obwodów zabezpieczających. Jednak mnóstwo innych, zarówno pojedynczych "3-woltowych", jak i pakietów, ma wbudowane różne lepsze czy gorsze zabezpieczenia.
W najprostszym przypadku elementem ochronnym może być wewnętrzny bezpiecznik, który przerwie lub ograniczy prąd o zbyt dużej wartości. Taki bezpiecznik może być jednorazowy albo termiczny (bimetaliczny), który zamknie obwód po ostygnięciu. Prąd ograniczy bezpiecznik polimerowy, czyli termistor PTC. W niektórych akumulatorach wbudowany jest termistor pomiarowy, zwykle o rezystancji 10 kW, wtedy akumulator ma trzy wyprowadzenia.
Niektóre akumulatory z trzema wyprowadzeniami mają w środku dużo bardziej zaawansowane obwody zabezpieczające i monitorujące, a trzecia końcówka służy do wymiany danych cyfrowych z zasilanym urządzeniem.
Nawet maleńkie akumulatory mogą mieć wbudowane elektroniczne obwody zabezpieczające. Nazywane są BMS (Battery Management Systems). Na fotografii 27 pokazane są dwa przykłady akumulatorów z wbudowanym zabezpieczeniem.
Dobry układ zabezpieczający powinien: zabezpieczyć przed przeładowaniem, nadmiernym rozładowaniem oraz przed zbyt dużymi prądami ładowania i rozładowania. Można to zrealizować, włączając w szereg z akumulatorem tranzystor MOSFET, który zostanie zatkany we wszystkich niepożądanych przypadkach. Trzeba jednak pamiętać, iż inny jest kierunek prądu podczas ładowania i rozładowania, a każdy MOSFET ma wbudowaną diodę między drenem a źródłem. Dlatego w obwodach zabezpieczenia akumulatorów stosuje się dwa (jednakowe) MOSFET-y połączone szeregowo.
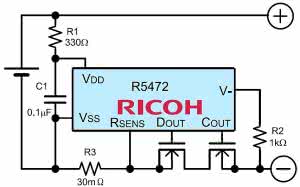
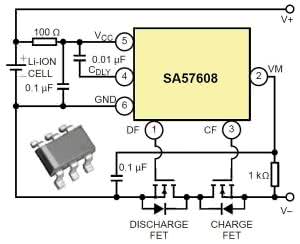
Istnieje wiele układów scalonych, zarówno do pojedynczych ogniw litowych, jak też do zestawów - pakietów. Rysunek 28 pokazuje schemat aplikacyjny układów zabezpieczających Ricoh R5472, wymagających zewnętrznych MOSFET-ów N. Rysunek 29 dotyczy kostki SA57608 Philipsa (NXP). Rysunek 30 pokazuje układ aplikacyjny bardziej inteligentnej kostki Dallas DS2720.
Akumulatory stosowane w laptopach mają kilka wyprowadzeń. Przykładowy schemat blokowy pokazany jest na rysunku 31. Bateria laptopa zawiera termistor, a także zaawansowany układ elektroniczny i mikroprocesorem. Układ ten nie tylko pełni rolę balansera podczas ładowania.
Zabezpiecza przed nadmiernym rozładowaniem, a ponadto cały czas monitoruje prądy ładowania i rozładowania i na tej podstawie określa liczbę cykli pracy, aktualną pojemność i stan akumulatora - dlatego w laptopach mamy precyzyjne informacje o stanie baterii i przewidywanym czasie pracy. Podobne monitorowanie wykorzystane jest w akumulatorach do lepszych elektronarzędzi.
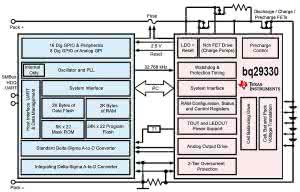
Zagadnienie jest szerokie, a producenci sprzętu nie są zainteresowani udostępnianiem ogółowi szczegółowych informacji o zastosowanych rozwiązaniach. Niemniej sporo informacji oraz użytecznych linków można znaleźć na forach dyskusyjnych i u producentów układów scalonych. Rysunek 32 przestawia schemat blokowy systemu zabezpieczającego pakiet akumulatorów z kostką Texas Instruments bq29330.
Temat zabezpieczeń jest bardzo szeroki, nie sposób omówić wszystkiego.
Na koniec warto wspomnieć, że najpopularniejsze akumulatory litowe - cylindryczne 18650 dostępne są w wersji "gołej", bez zabezpieczeń, oraz w wersjach z wbudowanym zabezpieczeniem (protected), które są o 3...5 milimetrów dłuższe. Pożyteczne dane na temat akumulatorów oznaczanych 18650 można znaleźć na stronie http://goo.gl/lqx2Y9, skąd pochodzi też rysunek 33, pokazujący budowę ogniwa z zabezpieczeniem.
Podsumowanie
Informacje podane w artykule sygnalizują najważniejsze zagadnienia, ale nie wyczerpują tematu akumulatorów litowych. Sytuacja rynkowa szybko się zmienia, ponieważ wciąż powstają nowe opracowania: akumulatory o większej pojemności i lepszych innych parametrach oraz ładowarki i układy zabezpieczające. Dlatego najświeższych informacji należy szukać u producentów.
Piotr Górecki
piotr.gorecki@elportal.pl

 Zaloguj
Zaloguj