Kiedy w grudniu 1809 r. Ephraim McDowell postanowił otworzyć brzuch kobiety cierpiącej na gigantycznych rozmiarów, ponad 5-kilogramową torbiel jajnika, tłum zebrany pod domem lekarza o mało nie zlinczował go za – zdaniem zebranej ludności – próbę morderstwa. Na szczęście (dla wszystkich) operacja udała się – McDowell zapisał się w historii jako ojciec chirurgii ogólnej, a jego następcy z biegiem lat coraz rzadziej byli postrzegani jako bezduszni oprawcy, a coraz częściej – jako wybawcy ostatniej szansy.
Nietykalne pozostawało jednak serce – tego organu bali się dotknąć skalpelem nawet najlepsi operatorzy ówczesnej medycyny i na wyrost wieszczyli, iż pierwszy, który ośmieli się zbezcześcić święty organ, zostanie z miejsca odrzucony przez całe środowisko lekarskie. A jednak, gdy jesienią 1896 roku do szpitala we Frankfurcie nad Menem trafił pchnięty nożem, 22-letni ogrodnik, chirurg Ludwig Rehn (fotografia 1) dokonał pierwszej udanej próby zszycia rany kłutej serca, ratując w ten sposób wykrwawiającego się pacjenta z objęć śmierci. Zamiast społecznej kary, na chirurga spłynęła sława pioniera i protoplasty kardiochirurgii, choć przed Rehnem byli już nieliczni śmiałkowie, którzy (bez sukcesu) próbowali dokonać tego samego.
Chirurgia rozwijała się coraz intensywniej, wtedy jednak jeszcze nikt (być może z wyjątkiem nielicznych wizjonerów-marzycieli) nie myślał poważnie o zostosowaniu jej do wszczepiania w ludzkie ciało jakichkolwiek bardziej złożonych urządzeń, mających na celu wspomaganie, regulację funkcji lub nawet zastępowanie narządów dotkniętych chorobą. Zamiast tego chirurdzy skupiali się wyłącznie na usuwaniu lub naprawianiu patologii anatomicznych, choć równie często wykorzystywali otwarcie jam ciała w celach diagnostycznych – ujrzenie wnętrza ciała pacjenta było jedyną metodą „medycznego rekonesansu” przed erą współczesnych technik obrazowania.
Wreszcie jednak, w 1958 roku, pod skórę klatki piersiowej pacjenta ze Szwecji, Arne Larssona (fotografia 2) trafił pierwszy w historii rozrusznik serca zastosowany u człowieka, co zapoczątkowało całkowicie nową erę w leczeniu najbardziej wymagających przypadków, dotąd skazanych na niechybną śmierć. Początki historii elektroniki implantowalnej są tożsame właśnie z tym wydarzeniem, choć w rzeczywistości powstanie pierwszego na świecie aktywnego implantu poprzedzało kilka innych wynalazków i pewne tragiczne wydarzenie, będące impulsem do szybkiego wdrożenia nowatorskiej technologii.
Na początku był… metronom
Pierwsze szeroko stosowane klinicznie rozrusznik wykorzystywane przy ciężkich zaburzeniach rytmu, zwłaszcza u pacjentów z tzw. blokiem serca, opracował Paul Zoll, bostoński kardiolog zainspirowany wcześniejszymi urządzeniami badanymi przez inne zespoły naukowców. PM-65 – bo tak brzmiała handlowa nazwa modelu – generował impulsy o napięciu 50...150 V, które były następnie dostarczane do serca przez niewielkie, metalowe elektrody, umieszczone na skórze pacjenta, a dodatkowo wyposażony został we własny elektrokardiograf. Zdecydowanie nie była to konstrukcja idealna – pomijając duże rozmiary i zasilanie sieciowe (które ograniczało zasięg mobilności systemu do długości kabla zasilającego), bodaj najistotniejszym problemem zauważonym podczas użytkowania rozrusznika okazały oparzenia skóry, spowodowane bolesnymi impulsami wysokiego napięcia. Co jednak najważniejsze – rozrusznik działał, czego dowodem byli kolejni uratowani pacjenci (w tym widoczny na fotografii 3 Pincus Shapiro – 76-letni przedsiębiorca, którego serce, dzięki trzymiesięcznej terapii zewnętrzną elektrostymulacją, zdołało wrócić do „stanu używalności”).
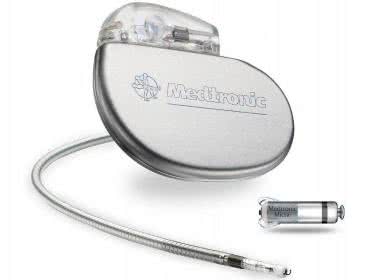
Podobnie jak każde inne urządzenie nie wyposażone w rezerwowe źródło energii, rozrusznik PM-65 działał tylko tak długo, jak pozwalała na to dostępność napięcia sieciowego. 31. października 1957 r. potężna awaria miejskiej sieci energetycznej w Minneapolis wyłączyła sprzęt obecny w salach pacjentów – niepodtrzymywany przez generatory rezerwowe, obsługujące jedynie sale operacyjne i pooperacyjne. Trzygodzinna przerwa w dostawie energii spowodowała śmierć dziecka, którego serce było podtrzymywane przez jeden z rozruszników PM-65. To tragiczne wydarzenie skłoniło jednego z pionierów kardiochirurgii – Clarence’a Waltona Lillehei’a – do skontaktowania się z inżynierem Earlem Bakkenem (fotografia 4), który 8 lat wcześniej założył w niewielkim garażu firmę... Medtronic (fotografia 5) – początkowo stanowiącą zaplecze techniczno-serwisowe dla pobliskiego szpitala.
Obydwaj panowie postanowili nie dopuścić do kolejnych tragedii i uniezależnić działanie rozrusznika od zaniku napięcia sieciowego. Bakken przypomniał sobie, że rok wcześniej w czasopiśmie Popular Electronics widział prosty projekt elektronicznego metronomu, opartego na oscylatorze blokującym, zbudowanym – co niezwykle ważne – na tranzystorach, a nie na prądożernych lampach, będących podstawowym budulcem rozruszników pierwszej generacji. Inżynier nieznacznie zmodyfikował układ, zamknął go w 10-centymetrowym, aluminiowym pudełku i wyposażył w banalnie prosty panel sterujący (fotografia 6).
Po krótkich testach, wykonanych na psie w szpitalnym laboratorium, urządzenie trafiło z powrotem do Lillehei’a, który – ku zaskoczeniu Bakkena – już następnego dnia zastosował je do podtrzymywania życia dziewczynki przebywającej na oddziale pooperacyjnym. Jak widać, sześć dekad temu ścieżka od prototypu do wdrożenia technologii medycznej była nieporównanie krótsza, niż dziś… Firma Medtronic rozrosła się natomiast do postaci jednego z największych koncernów na rynku technologii medycznych, stając się potentatem w zakresie zaawansowanej diagnostyki i terapii w różnych obszarach medycyny. Dziś koncern zatrudnia 90 tysięcy pracowników i uzyskuje roczny przychód rzędu 31 miliardów dolarów (dane za rok 20221).
Dwa tranzystory i pasta do butów
Zastosowanie tranzystorów oraz zasilania bateryjnego umożliwiło wielokrotną miniaturyzację stymulatorów względem konstrukcji „wózkowych”, zaś przejście ze stymulacji przezskórnej na nasierdziową (tj. z elektrodami mocowanymi bezpośrednio na sercu) pozwoliło zniwelować problem oparzeń i bólu. Niestety w branży medycznej każda decyzja ma swoje konsekwencje – w tym przypadku wyprowadzenie elektrod z klatki piersiowej poza obszar ciała pacjenta wiązało się z ryzykiem infekcji w miejscach wyjścia kabli z otworów w skórze. Z tego powodu – a także z uwagi na ergonomię – zaczęto poszukiwania jeszcze lepszej metody stabilizacji rytmu serca. Stąd już prosta droga prowadziła do kolejnego przełomu, którego dokonali: chirurg Ake Senning oraz wynalazca Rune Elmqvist. Ósmego października 1958 roku odbyła się pierwsza w historii implantacja wszczepialnego rozrusznika (fotografia 7).
Konstrukcja bazowała na dwóch tranzystorach PNP (rysunek 1) – pierwszy z nich pracował w roli generatora blokującego, drugi – stopnia wyjściowego, sprzężonego zmiennoprądowo z elektrodami nasierdziowymi. Co ciekawe, układ był wyposażony w bardzo prosty obwód… ładowania indukcyjnego – cewka widoczna po lewej stronie schematu okalała elektronikę i współpracowała z jednopołówkowym prostownikiem, umożliwiając doładowywanie dwóch połączonych szeregowo akumulatorków Ni-Cd (o pojemności 60 mAh każdy) za pomocą zewnętrznego pola magnetycznego o częstotliwości 150 kHz. Urządzenie musiało być doładowywane co 12 godzin za pomocą 25-centymetrowej cewki, mocowanej na klatce piersiowej pacjenta i zasilanej generatorem lampowym.
Całość zmontowanej metodą na pająka elektroniki zalano biozgodną żywicą epoksydową (Araldite), w formie wykonanej z... puszki po paście do czyszczenia butów marki Kiwi. Średnica tak wytworzonej obudowy wynosiła około 55 mm, a grubość 16 mm. Urządzenie generowało impulsy o amplitudzie rzędu 2 V i fizjologicznej częstości 70...80 uderzeń/min. Pierwsza wersja stymulatora, wszczepiona z zastosowaniem torakotomii lewostronnej (nacięcia w ścianie klatki piersiowej), pracowała zaledwie 8 godzin, zaś kolejna już cały tydzień. Za rekrutację pierwszego pacjenta odpowiadała jego żona (fotografia 8), która – dowiedziawszy się o trwających badaniach nad implementacją rozrusznika – postanowiła przekonać chirurga do wszczepienia urządzenia jej mężowi.
Nie zraziła jej nawet odpowiedź lekarza, który poinformował zdesperowaną kobietę, że jego niewielki zespół nie dysponuje jeszcze aparatem gotowym do implantacji. Else Marie Larsson skwitowała brak finalnej wersji rozrusznika bardzo krótko: „więc zróbcie taki!”. Trudno dziwić się jej desperacji, gdyż ukochany mąż każdego dnia zmagał się z 20...30 omdleniami pochodzenia kardiogennego. Po zabiegu mężczyzna został pierwszym na świecie człowiekiem, który powrócił do normalnej aktywności, będąc całkowicie zależnym od stymulatora i przeżył jeszcze 43 lata, podczas których urządzenie wymieniano jeszcze 25 razy. Pacjent zmarł niemal 1,5 roku po Senningu, który – nawiasem mówiąc – był jego rówieśnikiem.
Warto dodać, że projekt pierwszego rozrusznika wszczepialnego od razu spotkał się ze znacznym zainteresowaniem środowiska techniki medycznej. Firma Elema Schonander, zatrudniająca Rune Elmqvista, po kilku akwizycjach i wynikających stąd zmianach nazwy (Siemes-Elema, Siemens-Pacesetter) została wykupiona przez St. Jude Medical w 1994 roku, po czym… St. Jude sam został w 2017 roku wchłonięty przez holding Abott, będący dziś jednym z najsilniejszych graczy na rynku zaawansowanych technologii z zakresu kardiologii, neuromodulacji, diagnostyki molekularnej i diabetologicznej.
Efekt motyla, czyli jak pomylenie kodu paskowego rezystorów wpłynęło na rozwój kardiologii
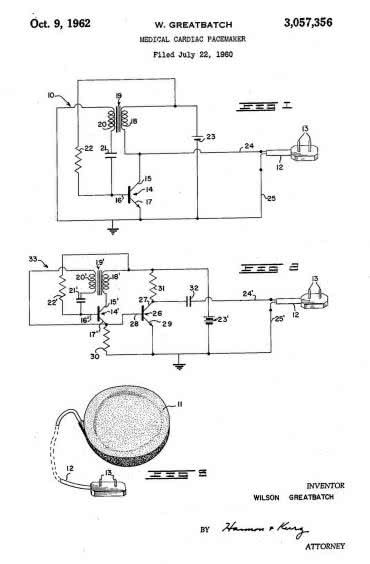
Jak to zwykle bywa w przypadku przełomowych odkryć i wynalazków, tak i rozrusznik serca został opracowany równolegle w innym zespole. Tym razem jednak innowacja powstała poniekąd przez przypadek – inżynier Wilson Greatbatch (fotografia 9), pracując nad nowym typem generatora elektronicznego, błędnie odczytał wartość rezystora, który zamierzał włączyć w obwodzie bazy jednego z tranzystorów. Mylnie identyfikując kod paskowy elementu, zamiast planowanego podzespołu o rezystancji 10 kΩ, z pudełka wziął rezystor 1 MΩ. Okazało się, że taka zmiana pozwoliła zbudować generator, który 1,8-milisekundowe impulsy wytwarzał z częstotliwością około 1 Hz, a co więcej – przez nieaktywną część okresu drgań układ pobierał pomijalny wręcz prąd zasilania.
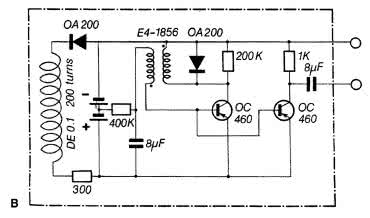
Greatbatch błyskawicznie skojarzył taką charakterystykę pracy z generatorem idealnym do użycia w roli stymulatora wszczepialnego, którego budowę rozważał już kilka lat wcześniej, zaś całą sytuację związaną z pomyłką wyjaśnił (jako człowiek głęboko wierzący) działaniem siły wyższej. Rozpoczął poszukiwania chirurga chętnego do współpracy w celu rozwinięcia tej koncepcji. Dr William Chardack ze szpitala w Buffalo zgodził się wejść w kooperację z inżynierem, wskutek czego – w maju 1957 – wystartowały testy na zwierzętach. W 1960 roku Greatbatch zgłosił konstrukcję do amerykańskiego urzędu patentowego.
Projekt rozrusznika występował w dwóch wersjach – jednotranzystorowej oraz dwutranzystorowej, w której (podobnie, jak w konstrukcji Elmqvista) drugi tranzystor pracował w roli stopnia wyjściowego, zwiększającego moc impulsu dostarczanego do mięśnia sercowego (rysunek 2). Pierwsza implantacja omawianej konstrukcji miała miejsce w 1960 roku, a niedługo później Greatbatch wraz ze współtwórcą rozrusznika – drem Williamem Chardackiem – sprzedał wyłączną licencję na konstrukcję urządzenia firmie Medtronic. Dziś głównym spadkobiercą dorobku inżyniera, który rozstał się później z korporacją z Minnesoty, jest firma Integer Holdings Corporation – łączny dorobek inżyniera przekracza 100 patentów i zgłoszeń patentowych, zaś Integer pozostał w obszarze elektroniki implantowalnej, dla której dziś oferuje szerokie portfolio komponentów i technologii.
Psy pod napięciem, czyli o trudnej drodze do wdrożenia ICD
Michel Mirowski (fotografia 10) był lekarzem polskiego pochodzenia – wykształcony w Lyonie, odbył rezydenturę w Izraelu oraz staże w słynnym szpitalu Johna Hopkinsa w Baltimore, a także w Instytucie Kardiologii w Mexico City. W 1967 roku dowiedział się o śmierci swojego przyjaciela, spowodowanej nawracającym częstoskurczem komorowym. Dla Mirowskiego, dotkniętego już wieloma tragicznymi wydarzeniami (podczas II Wojny Światowej naziści w ramach Holokaustu wymordowali całą jego rodzinę, co zmusiło go do emigracji), ta strata stała się impulsem do rozwoju całkowicie nowego typu urządzenia implantowalnego. Wszczepienia pierwszego kardiowertera-defibrylatora (ICD) dokonał dr Levi Watkins w 1980 roku u 57-letniej pacjentki z wieloma epizodami częstoskurczu komorowego w historii leczenia.
W przeciwieństwie do rozruszników, początki historii rozwoju ICD były jednak wielokrotnie dłuższe i zdecydowanie nie usłane różami. Prace Mirowskiego zaczęły się w 1968 roku przy udziale kardiologa Mortona Mowera2 i pomimo niebywałej innowacyjności, spotkały się z silnym oporem środowiska medycznego. Po niemal 100 latach od słynnej operacji Ephraima McDowella – jak na złość – znów wybawcy tysięcy ludzkich istnień zostali posądzeni o działanie nieetyczne. Po pierwsze – aby sprawdzić działanie wszczepionego urządzenia, trzeba było sztucznie wywołać epizod migotania komór (ciężkie zaburzenie rytmu serca), co samo w sobie stanowi zagrożenie dla pacjenta (pomimo ściśle kontrolowanych warunków i doskonałego zaplecza aparaturowego oraz farmakologicznego podczas zabiegu).
Po drugie – w owych czasach detekcja częstoskurczu oraz migotania komór była znacznie trudniejsza, niż dziś, w dobie niskomocowych procesorów DSP. Po trzecie – przerwanie epizodu tachykardii wydawało się mało realne przy użyciu niewielkiego, zasilanego bateryjnie urządzenia. Po czwarte – idea wszczepienia wysokonapięciowego generatora pod skórę pacjenta wydawała się podówczas bardzo kontrowersyjna, pomimo oczywistych zalet, jakie technologia ICD mogła przynieść kardiologii.
Nieufność środowiska lekarskiego była na tyle zaawansowana, że nawet nagrania wideo z przebiegu testów na 25 psach, u których urządzenie było w stanie nie tylko na żądanie wywołać, ale przede wszystkim szybko i skutecznie zakończyć epizod zaburzeń rytmu serca, nie zdołały przekonać kolegów po fachu, a zespół spotkał się nawet z absurdalnymi zarzutami, że psy były… wytrenowanymi aktorami, zaś cały eksperyment został sfałszowany.
Opór świata medycyny sprawił, iż coraz silniejszy wówczas Medtronic – zatrudniający w owym czasie prawie 5000 pracowników i generujący roczny przychód na poziomie 250 mln. dolarów (!) – odrzucił koncepcję ICD, pomimo wstępnego zainteresowania wspomnianego już wcześniej Earla Bakkena. Zdanie decydentów było jednoznaczne – środowisko medyczne trzeba będzie przekonywać przez kolejne 20 lat do praktycznego stosowania ICD. I choć pomylili się oni zaledwie o kilka lat (FDA zaaprobowała użycie ICD już w 1985 roku, czyli 17 lat po rozpoczęciu prac), to i tak Mirowskiemu oraz jego zespołowi należy się wielkie uznanie za doprowadzenie tak ryzykownego projektu do samego końca. Tym bardziej, że pierwsze badania kliniczne były obciążone sporą śmiertelnością (spowodowaną co prawda nie przez samo urządzenie, ale przez konieczność implantacji elektrod nasierdziowych w procedurze torakotomii), co przy braku silnej determinacji zespołu zapewne doprowadziłoby do przerwania prac.
Pierwsze konstrukcje ICD „cierpiały” z powodu dość długiego czasu niezbędnego na ponowną aktywację po wyładowaniu, co sprawiło, że znaczne wysiłki zostały włożone w przyspieszenie ładowania urządzenia. Po pionierskim kardiowerterze-defibrylatorze o oznaczeniu AID stworzona została wersja AID-B (fotografie 11 i 12), częściowo rozwiązująca ten problem, choć – podobnie, jak jej poprzedniczka – także produkowana na indywidualne zamówienie. Warto bowiem dodać, że w owym czasie urządzenia nie były jeszcze wyposażone w funkcję programowania do określonych potrzeb danego pacjenta. Wbudowane baterie litowe zapewniały 3-letnią pracę urządzenia, w trakcie której mogło ono dostarczyć do 100 „strzałów” ratujących życie, przy czym każdy impuls miał energię rzędu 25...30 J.
Rozwoju ciąg dalszy – więcej, dłużej i lepiej
Dalsze, przełomowe pod względem funkcjonalnym, osiągnięcia w dziedzinie elektrostymulacji serca były przejawem rozwiązywania kolejnych problemów i niedogodności ówczesnych projektów, jednak przy wyraźnej kontynuacji wypracowanej dotąd ogólnej formy urządzeń. Powróćmy zatem jeszcze na chwilę do lat 60. XX w. W kolejnych wersjach rozruszników żywiczne obudowy zostały wyparte przez szczelne puszki tytanowe (fotografia 13), zaś elektrody nasierdziowe – wymagające implantacji za pomocą torakotomii – zostały w 1962 roku zastąpione przez łatwiejsze i mniej inwazyjne elektrody wprowadzane za pomocą procedur przeznaczyniowych pod wizyjną kontrolą z użyciem fluoroskopii (ciągłego obrazowania klatki piersiowej pacjenta za pomocą promieniowania rentgenowskiego), co pozwoliło na wykonywanie procedury implantacji lekarzom nie będącym chirurgami. Zmiana konstrukcji i sposobu mocowania elektrod była konieczna, gdyż twórcy kolejnych generacji urządzeń elektroterapeutycznych wciąż zmagali się po drodze z szeregiem problemów, niezwiązanych już bezpośrednio z samą elektroniką – elektrody nasierdziowe szybko traciły swoją funkcjonalność przez pogarszające się z dnia na dzień parametry elektryczne interfejsu metal-tkanka, zaś przewody nie wytrzymywały kolejnych cykli obciążeń mechanicznych i pękały tak, jak każdy inny rodzaj kabla.
Coraz rzadziej wewnątrz obudowy można było spotkać plątaninę przewodów, która ustępowała miejsca płytkom drukowanym – początkowo w technologii przewlekanej (fotografia 14), choć tak szybko, jak było to możliwe, producenci przeszli na montaż powierzchniowy (fotografia 15).
Co ciekawe, pomiędzy erą metody na pająka, a PCB, można było także spotkać konstrukcje pośrednie, czego dowodem jest artystyczna wręcz forma jednego z wczesnych modeli firmy Medtronic, pokazana na fotografii 16.
Warto dodać, że łudząco podobne rozwiązanie jest stosowane do dziś, jednak nie do łączenia elektroniki wewnątrz obudowy, ale do wykonywania połączeń pomiędzy stykami złączy elektrod a portem wyprowadzonym z hermetycznej obudowy rozrusznika/ICD (fotografia 17).
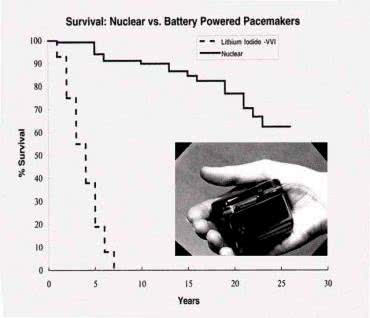
W latach 70. XX wieku zbudowano i wszczepiono pierwszy rozrusznik programowalny za pomocą pola magnetycznego, ta sama dekada przyniosła także implantację pierwszego rozrusznika z zasilaniem nuklearnym (Medtronic ogłosił powstanie takiej konstrukcji dwa lata wcześniej). Radioizotopowe generatory termoelektryczne (fotografia 18), pomimo wielokrotnie dłuższego czasu eksploatacji w porównaniu do chemicznych źródeł energii, nie zostały jednak spopularyzowane z uwagi na szereg problemów natury formalnej – zastosowany w urządzeniach Pluton-238 był silnie toksyczny, co w okresie, gdy rozruszniki miewały jeszcze nierzadko problemy ze szczelnością obudowy, mogło skończyć się tragicznie dla pacjenta.
Poza tym radioaktywny charakter zasilania utrudniał pacjentom swobodne podróżowanie, zaś na wszczepiających takie rozruszniki lekarzach prawo wymuszało konieczność usunięcia urządzeń po śmierci pacjentów oraz odpowiedniego zutylizowania szkodliwych odpadów. Nie zawsze było to jednak możliwe, gdyż… pacjenci umierali długo po przejściu ich lekarzy na emeryturę (choć same rozruszniki działały nadal i być może pracują do dziś, gdyż żywotność zasilania nuklearnego ocenia się na ponad 80 lat! – rysunek 3).
Sytuację odmieniło wprowadzenie nowego typu baterii – najpierw cynkowo-rtęciowych, a potem litowo-jodowych (opracowanych przez Greatbatcha i wydłużających czas pracy urządzeń do około 10 lat). Koniec lat 70. przyniósł rozruszniki z komunikacją dwukierunkową, rozpoczęto też stosowanie stymulatorów dwukomorowych (1978). W 1985 r. pojawiły się pierwsze urządzenia z korekcją szybkości rytmu serca w zależności od aktywności fizycznej użytkownika, co umożliwiło dostrojenie rytmu serca do stale zmieniających się potrzeb fizjologicznych pacjenta. Rozrusznik Activitrax™ firmy Medtronic (fotografia 19) został bowiem wyposażony w piezoelektryczny czujnik drgań, który wykrywał zwiększoną aktywność pacjenta i na tej podstawie podkręcał częstotliwość generatora. Echo tej przełomowej technologii – udoskonalonej przez zastosowanie bardziej zaawansowanych algorytmów i zmianę z prostych czujników piezo na niskomocowe akcelerometry MEMS – można znaleźć, także we współczesnych konstrukcjach.
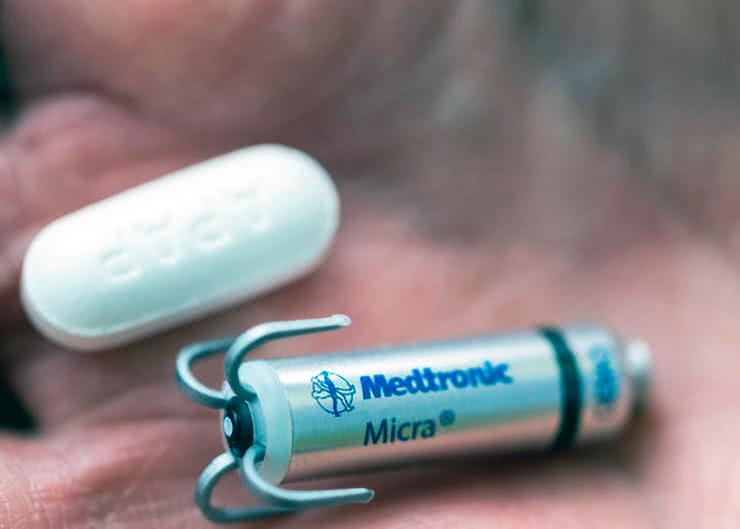
Co ciekawe, technologia elektrostymulacji rozwija się nadal, a najnowsze zdobycze technologii nie wiążą się tylko z wprowadzaniem innowacji w postaci funkcji telemetrycznych, ulepszonych algorytmów detekcji zaburzeń rytmu serca, czy też wbudowywaniem dodatkowych funkcji pomiarowych. I choć miniaturyzacja jest doprawdy spektakularna – co widać najlepiej na przykładzie miniaturowego rozrusznika Micra TPS, zaimplantowanego po raz pierwszy w 2013 roku (fotografia 20) – to całkiem niedawno byliśmy świadkami jeszcze jednego przełomu w tej dziedzinie medycyny.
Dopiero na przełomie XX i XXI wieku powstała bowiem terapia resynchronizująca (CRT), w ramach której stymulacji podlegają nie tylko prawe jamy serca (przedsionek i komora), lecz także lewa komora. Dziś rozruszniki (CRT-P) oraz defibrylatory (CRT-D – fotografia 21) wyposażone w dodatkową elektrodę tworzą jedno z podstawowych narzędzi terapeutycznych w niewydolności serca, spowodowanej niektórymi zaburzeniami rytmu (powodującymi rozsynchronizowanie skurczów obu komór serca). W tym przypadku jednak mamy do czynienia – od strony technicznej – z rozszerzonymi wersjami opisanych wcześniej urządzeń (rozrusznika oraz ICD), nie zaś z całkowicie nową technologią, budowaną od podstaw.
Stymulatory serca stworzyły podwaliny innych obszarów elektroniki implantowalnej. Doświadczenia zdobyte na przestrzeni kilku dekad pozwoliły opracować rozmaite rodzaje neurostymulatorów mózgu i rdzenia kręgowego, implantów regulujących pracę żołądka, pęcherza moczowego, a nawet baroreceptorów, odpowiedzialnych za autonomiczną regulację ciśnienia krwi. W każdym z wymienionych przypadków można już na pierwszy rzut oka zauważyć niebywałe podobieństwa konstrukcyjne – choć poszczególne implanty istotnie różnią się między sobą pod względem zastosowanych metod stymulacji, algorytmów sprzężenia zwrotnego, liczby elektrod, czy też dodatkowych funkcjonalności, jedno jest pewne – opisane powyżej, doniosłe wynalazki techniki medycznej utorowały drogę do eksploracji kolejnych branż medycyny.
Dwugłowe psy i patenty brzuchomówcy
Elektryczne wspomaganie układu krążenia rozwijało się niezwykle szybko już od połowy XX wieku, nadal jednak pozostawały problemy niezwiązane bezpośrednio z zaburzeniami rytmu serca. Wszelkie poważniejsze schorzenia natury hemodynamicznej – czyli, najprościej rzecz ujmując, wynikające z patologii w zakresie mechanicznej akcji serca, wciąż okazywały się śmiertelnym zagrożeniem dla pacjentów. Wraz z rozwojem kardiologii udawało się ratować pacjentów w coraz gorszym stanie zdrowia, choć w przypadkach schyłkowej niewydolności serca jedynym wyjściem wydawała się jego transplantacja. Kardiochirurgia poradziła sobie także z tym problemem, zaś rozwój immunosupresji oraz zaawansowanych technik diagnostycznych umożliwił lepsze prowadzenie najbardziej wymagających pacjentów. Rozwiązanie zagadnienia przeszczepu rzuciło jednak nowe światło na kolejne problemy – liczba serc kompatybilnych biologicznie z dawcami jest stosunkowo mała, a skrajnie niewydolni krążeniowo pacjenci nie mogą zbyt długo czekać na odpowiedniego dawcę. Medycyna znów zwróciła się w stronę inżynierii po pomoc – niezbędne okazało się bowiem opracowanie całkowicie sztucznego serca, które albo odciąży naturalne serce pacjenta, albo w pełni zastąpi je w jego klatce piersiowej.
Pierwsze próby zastąpienia biologicznego serca maszyną były wykonywane jeszcze przed spektakularnym rozwojem kardiochirurgii, a wynikały często z zupełnie innych pobudek. Pod koniec lat 30. XX wieku rosyjski lekarz Vladimir Demikhov (ten sam, którego nazwisko obiegło świat po udanym przeszczepie dodatkowej psiej głowy do ciała innego, żyjącego czworonoga) przeprowadził próby sztucznego serca na zwierzętach. Historia zna szereg tego typu eksperymentów, wśród których da się zauważyć wyraźną tendencję stopniowego wydłużania czasu przeżycia stworzeń poddawanych badaniom, liczonego w godzinach, dniach, a następnie tygodniach, a nawet miesiącach.
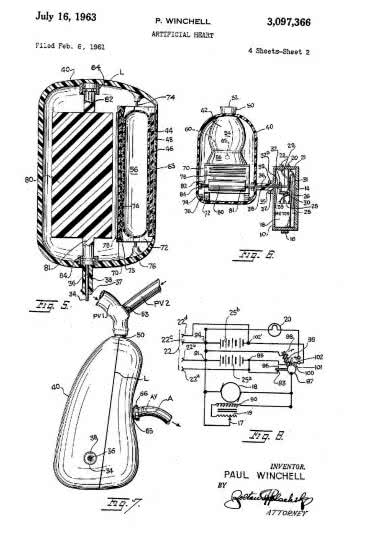
Pierwsze sztuczne serce przeznaczone do wszczepienia do ciała człowieka zostało opracowane przez duet w składzie: Paul Winchell (wzięty hollywoodzki aktor o polskich korzeniach, brzuchomówca i wynalazca, który dzięki medycznemu wykształceniu był w stanie opracować szereg patentów z pogranicza technologii i medycyny) oraz Henry Heimlich (amerykański torakochirurg i wynalazca, który do historii medycyny przeszedł głównie za sprawą manewru Heimlicha – do dziś pozostającego podstawową metodą pierwszej pomocy przy zadławieniach). Patent na rozwiązanie został przyznany w roku 1963 (rysunek 4).
Zaledwie 3 lata później jeden z najsłynniejszych kardiochirurgów XX wieku – Adrian Kantrowitz, który zasłynął z pierwszego w USA przeszczepu serca (u niego odbywał jeden ze staży prof. Zbigniew Religa) – dokonał pierwszego wszczepienia urządzenia do wspomagania lewej komory serca. Po kolejnych trzech latach pierwsze w historii, całkowicie sztuczne serce trafiło do klatki piersiowej pacjenta oczekującego na przeszczep i z sukcesem pracowało tam przez 64 godziny (fotografia 22).
Początek lat 80. XX wieku przyniósł pierwsze działające egzemplarze sztucznego serca, przeznaczonego do długotrwałej eksploatacji. Zostały opracowane przez Roberta Jarvika – wynalazcę i lekarza, którego choroba ojca zainspirowała do zajęcia się budową mechanicznego zamiennika skrajnie niewydolnego mięśnia sercowego. Serce Jarvik-7, wszczepione w 1982 emerytowanemu dentyście przez Williama DeVriesa, pracowało w ciele pacjenta przez 112 dni, zaś kolejny pacjent przeżył z urządzeniem aż 620 dni. Projekt Jarvik-7 (fotografia 23) udało się doprowadzić do etapu stosowalności klinicznej, choć z uwagi na problemy z utrzymaniem jakości produkcji oraz serwisu, FDA wycofała w 1990 roku pozwolenie na korzystanie ze sztucznego serca Jarvika.
Po kilku dekadach okazało się, że w wielu przypadkach zamiast podłączania mechanicznych komór lub nawet pełnego zamiennika tego organu wystarczy... niewielka pompka, umieszczona w nacięciu w dolnej części mięśnia sercowego i podłączona do aorty wstępującej. Dziś takie produkty oferuje szereg firm, w tym także założone przez Jarvika w 1987 roku przedsiębiorstwo Jarvik Research, Inc. (fotografia 24). Znów to, co kiedyś wydawało się niemożliwe, okazało się niemalże rutynową procedurą, stosowaną w szpitalach na całym świecie. Nadal konstruktorzy i lekarze zmagają się jednak z szeregiem problemów – podobnie jak w przypadku pierwszych rozruszników z elektrodami nasierdziowymi, tak i teraz, w przypadku przewodów pneumatycznych zasilających wszczepione do klatki piersiowej sztuczne serce, dają o sobie znać infekcje wokół miejsca wyprowadzenia przewodów. I to właśnie one okazują się jedną z najczęstszych komplikacji podczas terapii LVAD.
„Butelka z prądem”, zupa i koci telefon
Elektryczność fascynowała człowieka już od wielu stuleci, jednak dopiero w XVIII wieku zaczęto coraz bardziej świadomie wykorzystywać to zjawisko w celach eksperymentalnych, a nieco później – także w zastosowaniach praktycznych. Benjamin Wilson już w 1748 roku wykorzystał butelkę ledejską (rysunek 5) – archetyp kondensatora do… eksperymentalnej stymulacji głowy niedosłyszącej kobiety.
Przykładając jedną z elektrod do jej skroni obserwował reakcję pacjentki na wysokonapięciowe wyładowanie. O dziwo, powtórzenie eksperymentu w ciągu kilku dni spowodowało poprawę słuchu kobiety, co rzecz jasna zachęciło Wilsona i kolejnych badaczy do podążania tą ścieżką. Pomysł z Anglii dotarł nawet do Włoch, gdzie Alessandro Volta postanowił sprawdzić go na własnej skórze (dosłownie), opisując w 1800 roku, że nieprzyjemne odczucie wyładowania elektrycznego, które poczuł – jak to opisuje – w mózgu, uznał za niebezpieczne i zaprzestał powtarzania tego wątpliwego etycznie eksperymentu. Co jednak ważniejsze: zwrócił uwagę na szum, słyszalny podczas stymulacji i porównał ów dźwięk (a dokładniej – wrażenie dźwiękowe) do odgłosu… gotującej się zupy.
Dopiero w 1930 roku dwóch badaczy z Princeton – Charles William Bray i Ernest Glenn Weaver (fotografia 25) – przeprowadziło interesujący, choć dość makabryczny eksperyment z wykorzystaniem (na szczęście nieprzytomnego) kota. Po otwarciu czaszki zwierzęcia podłączyli bowiem do nerwu słuchowego… kabel, biegnący do pobliskiego telefonu. Podczas, gdy jeden z naukowców mówił do „podłączonego” ucha, drugi nasłuchiwał przebiegów wytworzonych przez nerw słuchowy w oddalonym o 15 metrów, dźwiękoszczelnym pokoju. Eksperyment miał niezwykle istotne znaczenie dla późniejszej protetyki słuchu, pokazał bowiem, że nerw słuchowy – w odróżnieniu od innych nerwów – odpowiada na pobudzenie w zupełnie inny sposób. Podczas gdy pozostałe nerwy reagują zwiększeniem częstotliwości impulsów na wzrost amplitudy stymulacji, w tym przypadku sygnał elektryczny jest silnie skorelowany zarówno z amplitudą, jak i częstotliwością stymulacji. Innymi słowy, ucho zaczęło być postrzegane jako biologiczny mikrofon, przetwarzający odebrany dźwięk do postaci elektrycznej kopii oryginalnej fali akustycznej.
W połowie XX w. neurofizjolog André Djourno oraz chirurg Charles Eyriès wykorzystali ponowną operację jednego z pacjentów (przeprowadzaną z powodu komplikacji po innym zabiegu ucha) do bezpośredniej stymulacji nerwu słuchowego z użyciem niewielkiej cewki indukcyjnej. Pomimo wstępnych sukcesów – pacjent odzyskał częściowo zdolność słyszenia prostych bodźców – pierwszy oraz drugi egzemplarz urządzenia przestały po pewnym czasie zdawać egzamin, co zniechęciło naukowców do kontynuowania badań.
Wyniki prac opublikowała prasa, a wycinek jednej z gazet, przyniesiony przez pacjenta, zainspirował Williama House’a i Johna Doyle’a do rozpoczęcia własnych prac nad protezowaniem słuchu. Panowie współpracowali przy tym z inżynierem elektronikiem, bratem Doyle’a o imieniu Jim. Na początku stycznia 1961 roku badacze zaimplantowali pojedynczą elektrodę, a niecały miesiąc później zastąpili ją już czterokanałową sondą, którą jednak po niedługim czasie musieli usunąć. Dość szybko współpraca Doyle’ów z Housem zakończyła się, zarówno z powodu zalewu telefonów od potencjalnych pacjentów (wieści zbyt szybko rozniosły się przez rozochoconą prasę), jak i z przyczyn osobistych – bracia zabronili lekarzowi dostępu do dokumentacji elektroniki, pomimo iż to przecież House zainicjował całą współpracę.
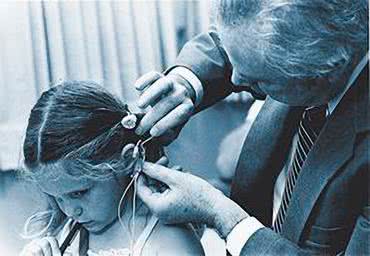
House nie poddał się jednak i już w 1972 roku wszczepiono pierwszy na świecie, noszony przez pacjenta (dziś określilibyśmy go mianem wearable) system transmisji indukcyjnej z mocowaniem magnetycznym, opracowany przez jego zespół. Dwa lata później odbyła się pierwsza międzynarodowa konferencja poświęcona elektrostymulacji nerwu słuchowego, a sam temat stawał się coraz bardziej gorący z naukowego, jak i użytkowego punktu widzenia. Ostatecznie, w 1984 roku FDA dopuściła do użytku pierwszy, komercyjny jednokanałowy implant ślimakowy dla dorosłych (fotografia 26).
Choć już 3 lata przed tym wydarzeniem miała miejsce pierwsza implantacja tego typu urządzenia u dziecka (fotografia 27), wielokanałowe implanty pediatryczne dla dzieci w wieku 2+ zostały dopuszczone dopiero w roku 1990, zaś dla niemowląt w pierwszym roku życia – dopiero w 2000 r.
Podsumowanie
Od wielu lat media i niektórzy naukowcy mamią nas wizją rychłego połączenia technologii z mózgiem człowieka poprzez realizację idei interfejsu mózg-maszyna. Nie brak też doniesień o innych metodach spektakularnej transformacji człowieka w bionicznego cyborga, naszpikowanego elektroniką od stóp do głów. Inni znów panikują przed „zaczipowaniem” społeczeństw i globalną kontrolą. Po raz kolejny okazuje się jednak, że prawdziwych innowacji należy szukać zupełnie gdzie indziej. Nie na pierwszych stronach gazet i magazynów popularnonaukowych, ale na salach operacyjnych i w laboratoriach badawczo-rozwojowych wielkich koncernów, które rozwinęły się z małych, garażowych firm lub ciasnych warsztatów, założonych przez wybitnych inżynierów przed kilkoma dekadami.
Historia pokazuje, że droga do osiągnięcia obecnego poziomu techniki implantowalnej była długa i wyboista, a jak to zwykle bywa w medycynie – pochłonęła też wiele ofiar, zarówno wśród zwierząt, na których prowadzono (z obecnego punktu widzenia niezbyt etyczne) badania podstawowe, jak i wśród pierwszych pacjentów, zmagających się z poważnymi powikłaniami po wszczepieniu prototypowych urządzeń. Na najwyższy podziw i uznanie zasługują wszyscy ci, którzy – wykazując się najwyższą odwagą – świadomie położyli się na stołach operacyjnych i pozwolili innowatorom na wdrożenie najświeższych, pionierskich wyników prac, prowadzonych w pocie czoła przez najbardziej otwarte umysły ubiegłego wieku. To właśnie im Autor pragnie zadedykować niniejszy artykuł.
inż. Przemysław Musz
Główne źródła informacji wykorzystanych w artykule:
- Thorwald J., Stulecie chirurgów, Wyd. Literackie, 1987
- Aquilina O. A brief history of cardiac pacing. Images Paediatr Cardiol. 2006 Apr; 8(2):17-81
- Ramsdale, D. r., Rao, A., Cardiac Pacing and Device Therapy, wyd. Springer London, 2012
- Efimov I.R., Kroll M.W., Tchou P.J., Cardiac Bioelectric Therapy. Mechanisms and Practical Implications, wyd. Springer Science+Business Media, 2009
- A Legacy of Innovation. The Medtronic Story, dost. online: https://t.ly/vxC4
- Mudry A, Mills M., The Early History of the Cochlear Implant: A Retrospective. JAMA Otolaryngol Head Neck Surg. 2013;139(5):446–453
- https://t.ly/9Adw
- https://t.ly/OBJpe
- https://t.ly/PPWY
- https://t.ly/56_WX

 Zaloguj
Zaloguj